CIENCIAS BIOLÓGICAS Y DE LA SALUD
Leptospirosis: explican el rol de los glóbulos blancos ante la bacteria que la causa
Expertos del CONICET describieron cómo reaccionan frente a ella unas células de la sangre que forman parte del sistema inmune innato.
La leptospirosis es una de las enfermedades transmitidas al ser humano por los animales –en especial especies de cría o roedores urbanos como ratas y ratones– de mayor prevalencia a nivel global, pero que por lo inespecífico de sus síntomas está subdiagnosticada, ya que se caracteriza por un estado febril y se la suele confundir con gripes o resfríos. Su implicancia a nivel sanitario y económico es relevante: 1 de cada 10 personas que la padecen puede sufrir una falla renal aguda conocida como síndrome de Weil, cuya tasa de mortalidad si no se trata es cercana al 50 por ciento; mientras que en la industria agropecuaria genera pérdidas importantes porque produce abortos, partos prematuros, infertilidad o pérdida de peso del ganado, entre otras complicaciones.
Con todo esto, cobra especial importancia el abordaje de estrategias para, por un lado, entender cómo se produce y, por otro, identificar posibles blancos de acción que permitan detectarla a tiempo. En eso trabajan investigadores del CONICET en el Instituto de Medicina Experimental (IMEX, CONICET-ANM) y el Instituto de Biotecnología y Biología Molecular (IBBM, CONICET-UNLP), quienes acaban de publicar un artículo en la revista Cellular microbiology en el que explican el rol que cumple un tipo de leucocitos o glóbulos blancos ante la presencia de la bacteria causante de la enfermedad y proponen una molécula como potencial marcador para su diagnóstico.
“Dentro del género Leptospira hay bacterias patogénicas, es decir que generan enfermedades, y otras que se denominan saprófitas, que no lo hacen”, apunta Ricardo Gómez, investigador principal del CONICET en el IBBM y uno de los autores del trabajo. “No está muy claro cómo se produce la leptospirosis. Se sabe que una vez que ingresa al organismo la bacteria patógena se disemina muy rápidamente por el torrente circulatorio y se mantiene allí hasta que la respuesta inmune del huésped, aquella que crea los anticuerpos específicos, la elimina de la sangre aunque persiste en el riñón durante meses, convirtiendo al hospedador en un reservorio que contamina el medio ambiente con su orina. La rápida diseminación supone que este agente invasor posee los mecanismos para evadir la primera línea de defensa que se conoce como sistema inmune innato, y es allí donde enfocamos nuestro estudio”, agrega.
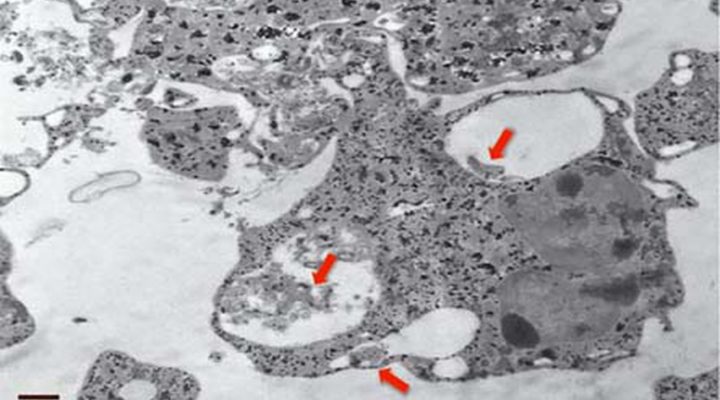
El trabajo se orientó a entender cuál es la respuesta frente a la presencia de la bacteria que dan los neutrófilos, las principales células de ese sistema inmune innato. Se trata del tipo más abundante de glóbulos blancos de la sangre de los humanos –del 60 al 70 por ciento del total–. “Contribuyen a atacar de distintas maneras a agentes invasores como gérmenes o bacterias. Hasta el momento no existían estudios previos en los que se describiera la relación entre ambos”, comenta Gómez.
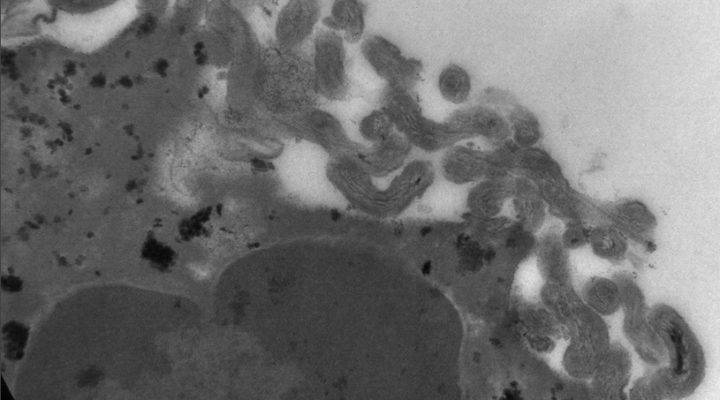
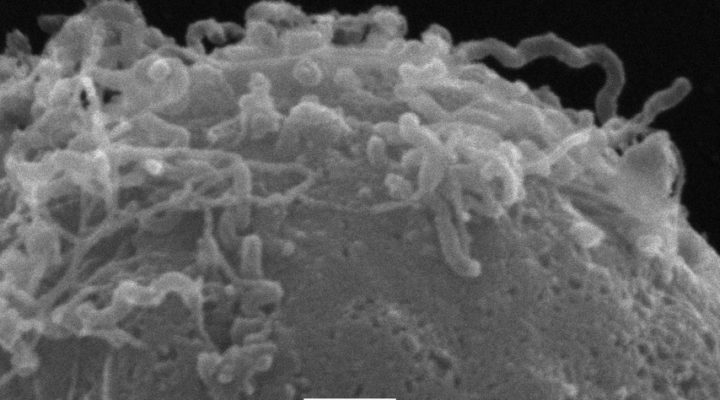
Los expertos estudiaron la respuesta de los neutrófilos expuestos a variantes de Leptospira patogénicas y a otras que no lo son. “En ambos casos lo que vimos es que estas células producen lo que se conoce como un estado proinflamatorio, es decir pasan del reposo a activarse en modo ataque y generan unas moléculas que luego intervendrán en la respuesta inmune adaptativa. Hasta el momento se creía que los neutrófilos no participaban, es decir que no registraban la presencia de la bacteria patógena. Con esto pudimos comprobar que sí lo hacen y de hecho actúan en la generación de la inflamación que sigue a la infección”, apunta María Florencia Ferrer, investigadora asistente del CONICET en el IBBM y parte del grupo de trabajo.
“Una diferencia importante que arroja el estudio es que los neutrófilos fagocitan, es decir capturan y digieren a las bacterias no patógenas, en cambio a las otras no: éstas se asocian a la superficie del neutrófilo y quedan adheridas allí. No sabemos cómo, pero de alguna forma logran inhibir la fagocitosis, que es uno de los procesos a través de los cuales estas células protegen al organismo de los microbios. Eso era algo que no esperábamos”, explica Gómez.
Además de aclarar cómo se comportan los neutrófilos ante la presencia de la bacteria agresora, otra contribución importante del trabajo es que propone a una determinada molécula como una herramienta para el diagnóstico temprano de la enfermedad en próximos estudios: “Es una proteína cuya expresión aumenta selectivamente ante la presencia del patógeno. A futuro, este tipo de hallazgos pueden ser útiles para detectarla a tiempo e implementar rápidos tratamientos. Como la leptospirosis está subdiagnosticada y su sintomatología es muy poco específica, contar con marcadores moleculares facilitaría el diagnóstico”, cierra Ferrer.
Por Marcelo Gisande – Centro Científico Tecnológico CONICET La Plata
Sobre investigación:
Nancy Charo. Becaria postdoctoral. ANPCyT. IMEX.
Emilia Scharrig. Becaria posdoctoral. IBBM.
María Florencia Ferrer. Investigadora asistente. IBBM.
Norberto Sanjuan. Investigador adjunto. IMPAM.
Eugenio Carrera Silva. Investigador adjunto. IMEX.
Mirta Schattner. Investigadora superior. IMEX.
Ricardo Gómez. Investigador principal. IBBM.