Ciencias Biológicas y de la Salud
Comprueban reversión de síntomas de proteinopatías neurodegenerativas en ratones
Observaron que al cesar la falla en la proteína TDP-43, asociada a estos trastornos, ciertas funciones cerebrales pueden volver a la normalidad.
Lionel Muller Igaz, investigador adjunto del CONICET en el Instituto de Fisiología y Biofísica Bernardo Houssay (IFIBIO Houssay, CONICET-UBA) logró junto a su equipo revertir trastornos cognitivos y motores en ratones modificados genéticamente que modelan casos de esclerosis lateral amiotrófica (ELA) y demencia fronto-temporal (DFT).
Estas enfermedades neurodegenerativas, llamadas proteinopatías de TDP-43, están relacionadas con la presencia en el citoplasma de la proteína de unión a ADN con respuesta transactiva de 43 kD (TDP-43, por sus siglas en inglés), que normalmente se encuentra en el núcleo de todas las células, explica Muller Igaz.
La conclusión a la que arribaron los investigadores, publicada en The Journal of Neuroscience, es que el deterioro conductual que se produce en estadios patológicos iniciales estaría relacionado con fallas en el funcionamiento de las neuronas que aún sobreviven, más que en la pérdida -degeneración- de las mismas.
En 2006 un equipo de la Universidad de Pensilvania, Estados Unidos, del que formó parte el investigador, había descubierto la presencia de agregados insolubles –cúmulos- y la relocalización de TDP-43 en el citoplasma de las neuronas afectadas en pacientes que sufren estas enfermedades neurodegenerativas. Este hallazgo es el que motivó a Muller Igaz a preguntarse: ¿Una vez que uno desencadena estos problemas es irreversible el cambio?
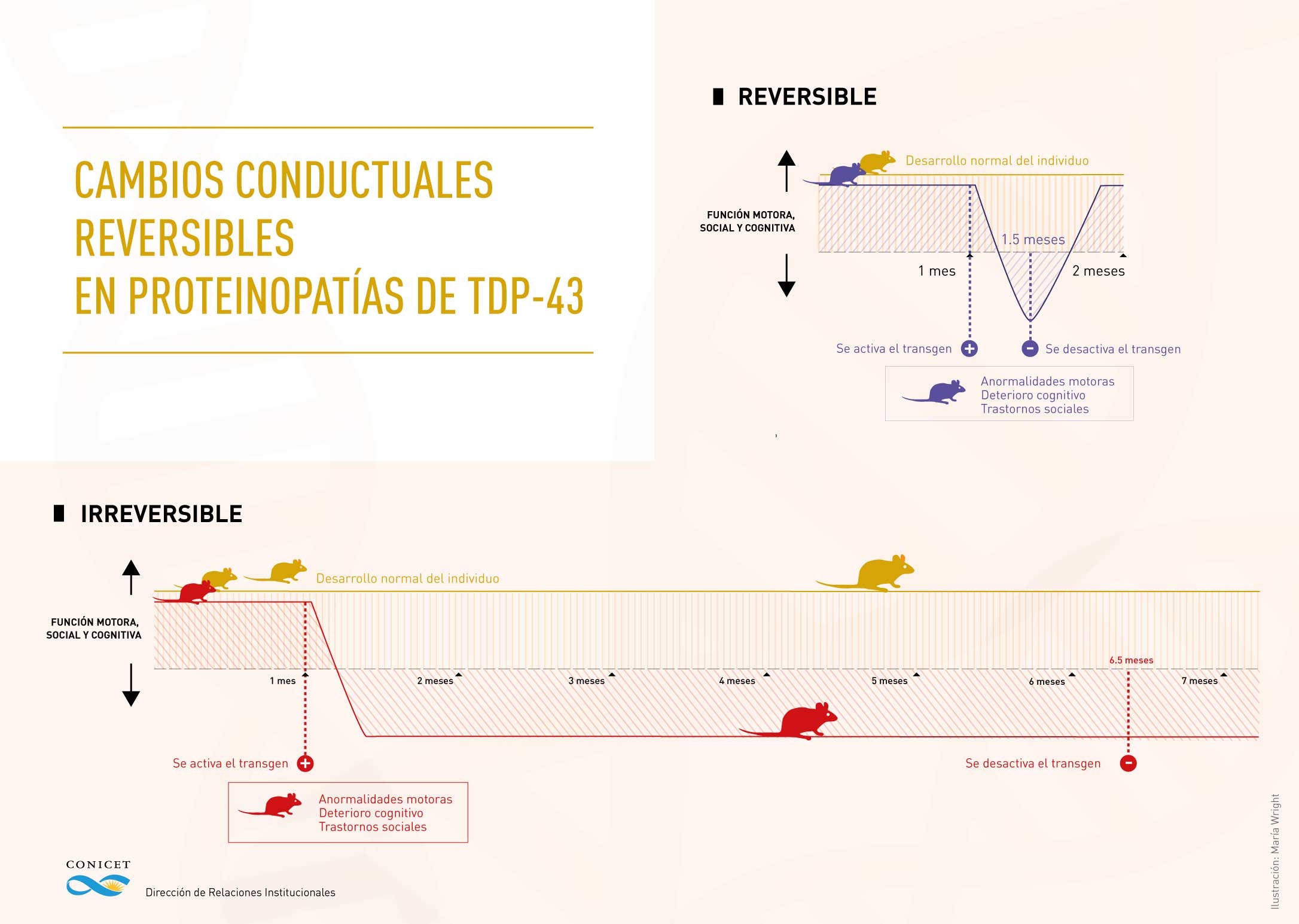
La manera de dilucidarlo consistió en el desarrollo de un modelo de ratones a los que se les insertó una secuencia de ADN –transgén- que codifica para una versión de TDP-43 que no permanece en el núcleo sino que se dirige al citoplasma, en cierto tipo de neuronas del cerebro. Este modelo animal permite activar y desactivar el transgén mediante la administración de fármacos en la comida o bebida de los ratones -un proceso llamado inducción- y así evaluar tres dominios conductuales: cognitivo, motor y social.
“Observamos que por la translocación al citoplasma de la proteína TDP-43 se producen déficits motores, cognitivos y sociales, todas alteraciones que se ven en pacientes con éstas proteinopatías”, grafica el investigador, quien además es docente de Fisiología y Biofísica en la Facultad de Medicina de la Universidad de Buenos Aires.
Se activó el transgén en el ratón de un mes y luego de 2 semanas se apagó, con lo que pudo observarse, en 14 días, un restablecimiento de las funciones motoras y cognitivas en su totalidad y un porcentaje del dominio social, lo que indicaría que parte de los circuitos neuronales que estaban deteriorados volvieron a normalizarse. Por el contrario, al apagarlo a los 5 meses y medio, ya con mayor muerte neuronal, no revirtió el daño, después de 14 días.
La detección de estos depósitos de proteínas en organismos vivos constituye otra línea de investigación que persiguen diferentes grupos de investigación, cuenta el científico, ya que, tal como ocurre con la mayoría de los agregados proteicos presentes en enfermedades neurológicas, sólo post-mortem es posible detectarlos.
”La comunidad científica está intentando arribar a la posibilidad de generar biomarcadores que puedan detectar a tiempo la presencia de estos agregados y generar fármacos que ataquen a la proteína TDP-43 en citoplasma”, agrega.
“Aunque hay que manejarse con mucha cautela, a partir de estos nuevos conocimientos podemos comenzar a profundizar en el entendimiento acerca de qué cambios produce esta proteína y comprender mejor la biología de esta modificación para encontrar una forma de revertir o al menos paliar la enfermedad”, concluye.
- Por María Bocconi
- Sobre investigación:
- Julio A. Alfieri, becario doctoral. IFIBIO-HOUSSAY.
- Natalia S. Pino.
- Lionel M. Igaz, investigador adjunto. IFIBIO-HOUSSAY.