Ciencias Exactas y Naturales / Ciencias Biológicas y de la Salud
Describen por primera vez un switch reversible en una proteína de la cadena celular de transferencia de electrones
Investigadores del CONICET demostraron la existencia de un interruptor en un componente de este proceso fundamental para la obtención de energía por las células.
La cadena de electrones es un sistema de proteínas de importancia fundamental ya que asegura la obtención de energía para las células por mecanismos de intercambio de electrones y protones de un lado al otro de una membrana, en la llamada respiración celular, la fotosíntesis, o la respiración de la mitocondria.
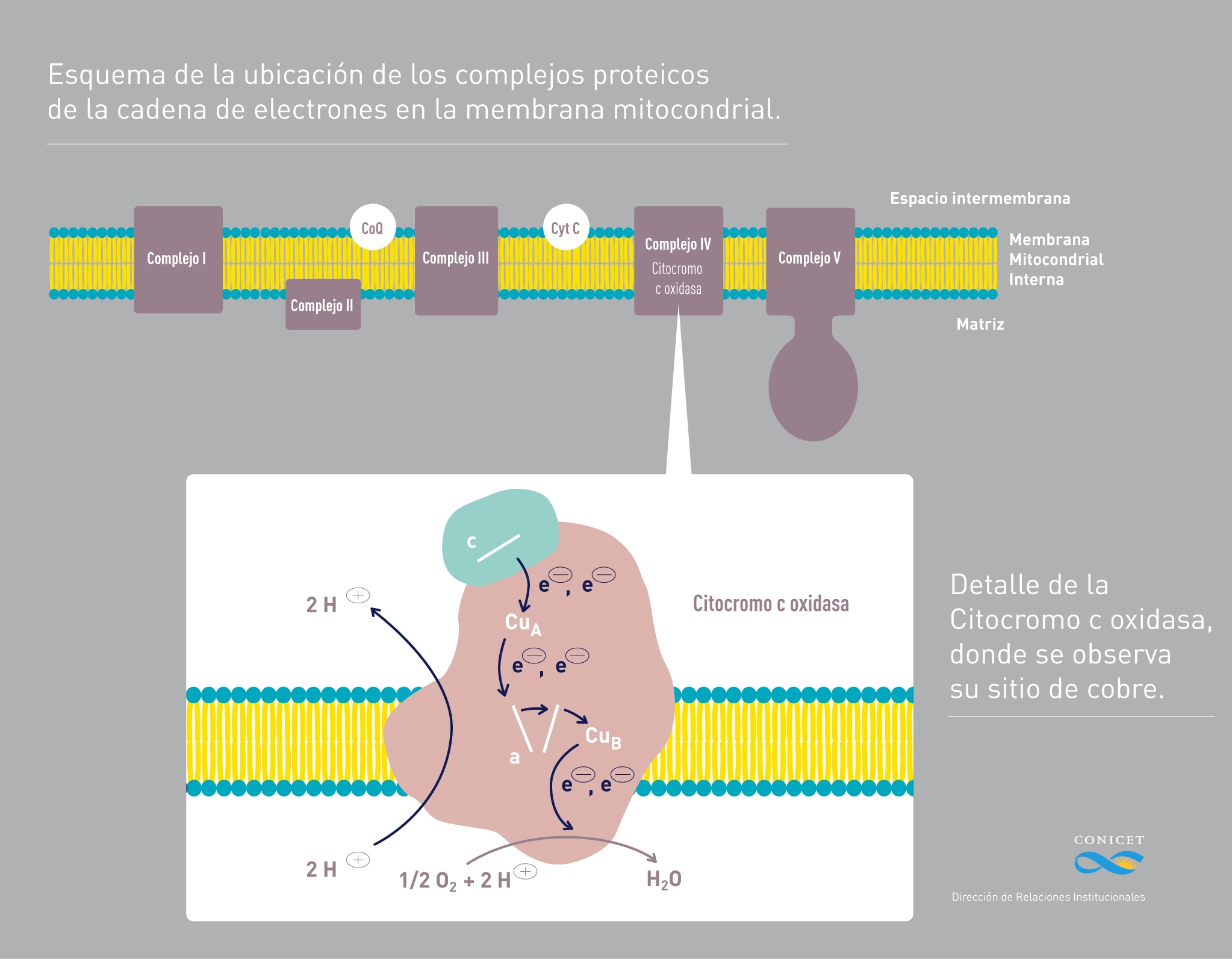
Entre estas proteínas se encuentra la citocromo c oxidasa, sobre la cual describieron este switch Daniel Murgida, investigador principal del Instituto de Química Física de los Materiales, Medio Ambiente y Energía (INQUIMAE, UBA-CONICET), en conjunto con Alejandro Vila, investigador superior del Instituto de Biología Molecular y Celular de Rosario (IBR, CONICET-UNR), junto a sus equipos de trabajo.
El descubrimiento fue publicado en la prestigiosa revista Angewandte Chemie y los primeros autores fueron Ulises Zitare, becario doctoral del CONICET, y Damián Álvarez Paggi, ambos del INQUIMAE.
Esta descripción a la que arribaron aporta un mayor conocimiento sobre la regulación de estos mecanismos de transferencia que están presentes en la respiración celular, en la respiración de las mitocondrias y en la fotosíntesis, y que responden a los mismos principios generales: una membrana con proteínas adosadas que intercambian electrones como fuente de energía para translocar protones de un lado a otro de la membrana, acumulando cargas para finalmente sintetizar ATP. “Uno espera que los mecanismos de regulación de estos sean muy similares a los que describimos en este trabajo”, asegura Murgida.
Para que este intercambio electrónico sea eficiente, describe el científico, “el electrón tiene que salir a, más o menos, 90 grados y no volver por la misma vía” y esta función la cumple este interruptor del que es la primera vez que se obtiene una descripción precisa: el sitio de cobre (Cu) de la proteína citocromo c oxidasa sería el implicado en la eficiencia de estos intercambios.
En el desarrollo de la investigación se utilizó una proteína modificada (M160H), que activaron y desactivaron reversiblemente mediante un cambio en los valores de pH. “El pH, además de ser una variante de fácil modificación, es muy importante en el ámbito en el que se anclan las proteínas de transferencia electrónica, ya que fluctúa debido al funcionamiento mismo de la cadena de transporte”, dice Álvarez Paggi.
“La proteína mutante M160H permitió confirmar que hay dos estados electrónicos que son activos en las reacciones de transferencia electrónica y esta alternancia de estados electrónicos es lo que permite la eficiencia y direccionalidad en las reacciones de transferencia electrónica”, explica Alejandro Vila, y agrega que: “mientras uno está optimizado para la entrada de los electrones, el otro favorece la salida”.
En la arquitectura electrónica de este interruptor existe un estado de alta energía intermedia, que era considerado hasta el momento como no operativo. Como explica Murgida, es comparable a un cuerpo a mitad de camino entre el piso y un sitio más elevado: “El cuerpo en el piso es el estado de mínima energía. Para este sitio de Cu nosotros encontramos que ambos estados son operativos transfiriendo electrones, e incluso el estado de alta energía es más eficiente”.
Los investigadores explican que este nuevo concepto es contrario a lo que la intuición podría determinar, ya que va en contra de principios establecidos en observaciones anteriores que describían el estado como una “curiosidad, pero no operativa”. La idea de que este estado de mayor energía sea operativo e incluso más eficiente, ejemplifican, “es como correr mejor y más rápido con una mochila pesada”.
Por otro lado, es interesante continuar las investigaciones fuera del campo de la biología, ya que “este tipo de metaloproteínas podrían utilizarse como interruptores y elementos de direccionamiento de electrones en el campo de la electrónica molecular”, explica Murgida.
En un trabajo anterior, también en conjunto con el IBR e INQUIMAE, se había propuesto la existencia de este switch que alterna la entrada y salida de electrones (carga negativa); con estos nuevos resultados queda lograda la demostración de su existencia.
“Desde el IBR aportamos los conocimientos bioquímicos y de biología molecular de proteínas REDOX (reducción/oxidación) así como el uso de Resonancia Magnética Nuclear para los estudios estructurales de las proteínas, mientras que el grupo del Dr. Murgida desarrolló tecnologías optimizadas para el estudio electroquímico de las proteínas REDOX y cálculos de mecánica cuantica computacional. La complementariedad entre grupos fue lo que permitió la publicación de este trabajo como culminación de un proyecto que, desde 2012, produjo otras publicaciones de alto impacto”, valora Vila.
Por su parte, Murgida coincide en que “son dos grupos que se complementan muy bien y tienen el objetivo de terminar de entender completamente cómo funciona la transferencia electrónica en los sistemas biológicos”.
- Por María Bocconi
- Sobre investigación:
- Ulises Zitare. Becario doctoral. INQUIMAE.
- Damián Álvarez Paggi. INQUIMAE.
- Marcos N. Morgada. Becario doctoral. IBR.
- Luciano A. Abriata. IBR.
- Alejandro J. Vila. Investigador superior. IBR.
- Daniel H Murgida. Investigador principal. INQUIMAE.