CIENCIAS BIOLÓGICAS Y DE LA SALUD
El desafío de reconocer el Parkinson antes de los primeros síntomas
Un equipo de científicos del CONICET La Plata estudia señales tempranas de esta enfermedad a nivel del funcionamiento celular.
Se conocen algunas mutaciones genéticas que predisponen para su aparición, y que son hereditarias. También se sabe que diversos factores ambientales contribuyen a dispararla. La enfermedad de Parkinson, trastorno neurodegenerativo del movimiento, no tiene un solo causante sino una suma de varios, que a su vez configuran circunstancias muy variables en cada paciente: la edad de los primeros síntomas clínicos detectables, la rapidez con que progrese, la respuesta a los tratamientos, entre otros. Comprender el origen de esas diferencias es lo que desvela a los científicos que estudian el tema a nivel mundial.
En esa búsqueda se encuentra Lisandro Falomir Lockhart, investigador asistente del CONICET en el Instituto de Investigaciones Bioquímicas de La Plata (INIBIOLP, CONICET-UNLP), que en 2013 regresó al país luego de más de tres años de trabajo en el prestigioso Instituto Max Planck de Química y Biofísica en Göttingen, Alemania. Desde entonces, ha adaptado distintos proyectos para continuar aquí las líneas que abordó durante su estadía en el exterior. “Nuestro objetivo principal es poder identificar qué es lo que desencadena la enfermedad en determinado momento de la vida. Conociendo ese primer paso podremos buscar, ya no maneras de enmascarar los síntomas como hacen los fármacos actuales, sino de evitar que aparezcan”, señala el experto.
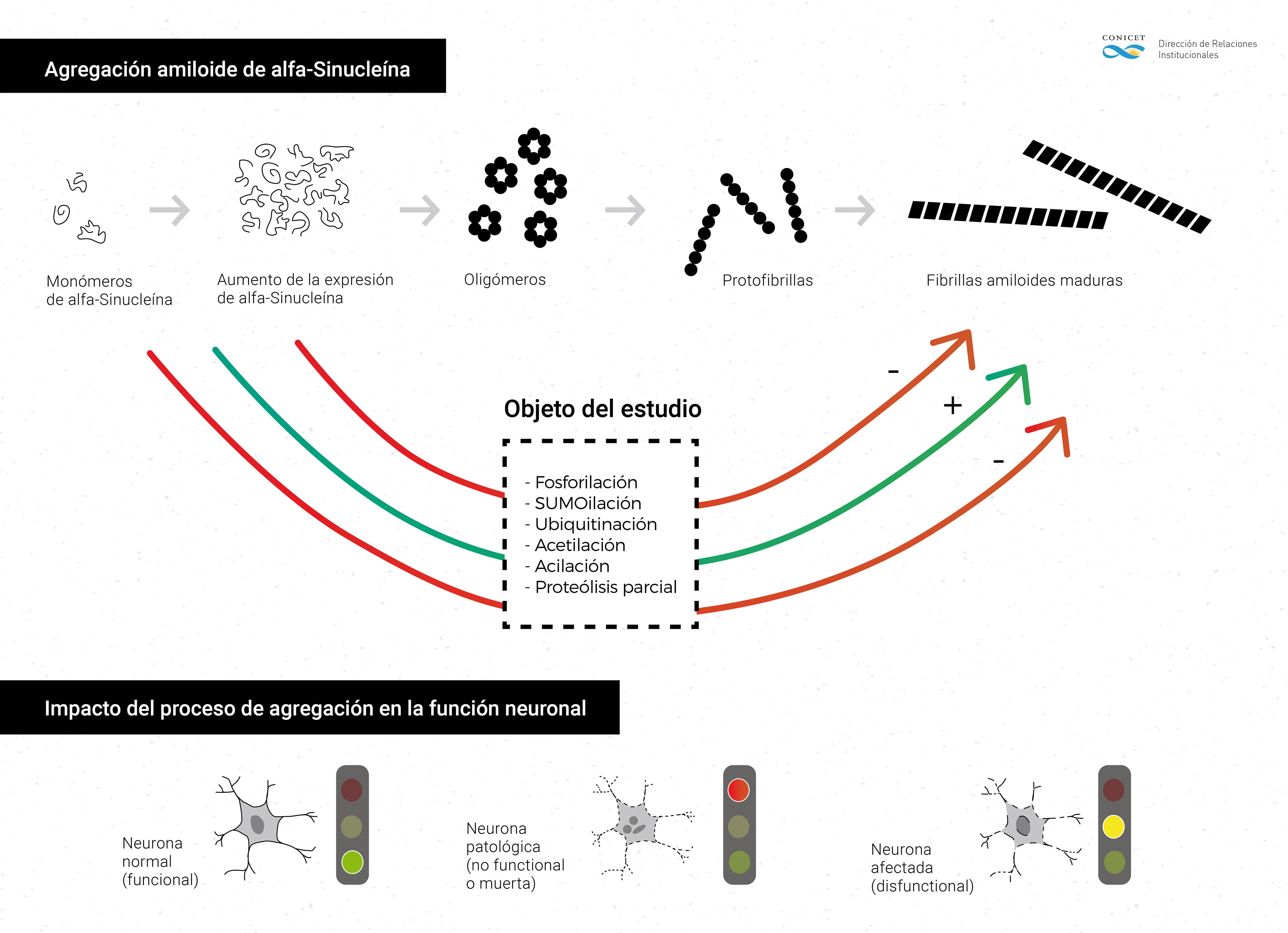
Concretamente, el equipo de trabajo que dirige se concentra en el estudio de una proteína llamada alfa-sinucleína, implicada tanto en Parkinson como en otras enfermedades neurodegenerativas. “Históricamente, el diagnóstico preciso de un paciente se daba post mortem por la presencia de unos cúmulos anómalos de proteínas llamados cuerpos de Lewy que se forman en el interior de las células del sistema nervioso, es decir las neuronas. Si bien fueron descriptos a comienzos del siglo XX, recién en 1997 se descubrió que el principal componente de estas estructuras patológicas era precisamente alfa-sinucleína, y desde entonces se la ha estudiado mucho”, explica.
Sin embargo –explica el científico- al analizar muestras de pacientes se observó que apenas menos del 5 por ciento presenta una mutación en el gen que codifica para esa proteína. “Hay seis alteraciones puntuales de alfa-sinucleína asociadas a la enfermedad. Pero la enorme mayoría de los casos no tiene ninguna: la molécula es completamente normal hasta que de repente adopta una función tóxica y empieza a acumularse dentro de la célula. La gran incógnita es qué ocurre para provocar esto. Las proteínas pueden sufrir cientos de cambios químicos durante su vida útil; a veces activándolas, otras silenciándolas, y en ocasiones convirtiéndolas en perjudiciales para las neuronas. Creemos que eso sucede porque sufre alguna modificación por influencia del entorno”, apunta Falomir Lockhart.
Justamente, como otra de las cuestiones que se conoce acerca del Parkinson es la gran influencia que ejerce el ambiente, la hipótesis del investigador es que la ganancia de esa función tóxica por parte de alfa-sinucleína podría estar asociada a una condición de estrés oxidativo, esto es, un desequilibrio en las reacciones químicas de las células y que, si bien se da naturalmente con el envejecimiento, en algunas personas toma este camino que lleva a las enfermedades neurodegenerativas. “Así, la proteína nativa, es decir, sana, sufriría una modificación que la hace interferir con el normal funcionamiento de las neuronas y, si además tiene una mutación genética predisponente, este proceso se acelera y puede aparecer tan temprano como a los 20 o 30 años de edad”, describe el especialista.
Para lograr identificar cuáles son esas modificaciones que afectan a alfa-sinucleína, el equipo está probando distintas variables modificando químicamente sus aminoácidos. Normalmente las células tienen mecanismos de depuración por el cual las proteínas que están funcionando mal son eliminadas. “Lo que pasa en estos trastornos neurodegenerativos es que en algún momento ese proceso se bloquea o no da abasto, y entonces se busca una alternativa para suprimir la actividad tóxica y es ahí cuando se cree que aparecen los cuerpos de Lewy. Si estos mecanismos fallan, la enfermedad progresa más rápido”, continúa.
Si bien en Alemania gran parte de las investigaciones se realizaban con células derivadas de pacientes, en el presente Falomir Lockhart y su equipo utilizan las proteínas aisladas generadas a partir de bacterias, lo cual les permite obtener una gran cantidad y analizar en un tubo de ensayo cómo cambia su funcionamiento en respuesta a las modificaciones a las que las van sometiendo. Estos experimentos se combinan con ensayos con células en cultivo que reproducen en gran medida las características de las neuronas para evaluar su impacto en las funciones celulares.
Cabe mencionar que en el exterior el investigador trabajaba con la técnica de reprogramación celular, por la cual se toma una célula cualquiera y, tras borrar su programación genética, se la transforma en otro tipo especializado. La experiencia en ese caso era con fibroblastos -presentes en tejido de la piel-, a los que se convertían en unidades muy parecidas a las neuronas.
“Mi intención ahora es extender este proyecto con estudios en fibroblastos de pacientes, pero sin reprogramarlos. Sería muy interesante porque en aquellas experiencias observamos que algunas alteraciones a nivel de metabolismo que vimos en neuronas maduras, ya se habían descripto cuando todavía eran fibroblastos, es decir antes de transformarlos”, señala Falomir Lockhart y añade: “Esto ofrece un modelo de trabajo más acorde a los recursos con los que contamos en Argentina para estudiar a ese nivel los distintos efectos que actúan en la interfaz en la que se combinan los factores externos con los genéticos para perturbar la función de alfa-sinucleína”.
El objetivo del proyecto es identificar las modificaciones específicas de la proteína presentes a partir de los primeros estadios de la enfermedad para poder desarrollar herramientas que permitan su detección en sangre como marcador temprano, incluso antes de que aparezcan manifestaciones clínicas, y así habilitar nuevas estrategias para combatir el Parkinson, que es la meta final del equipo. “Creemos que estamos encaminados porque observamos esa ganancia de efecto tóxico en un trabajo previo que dio origen a los ensayos actuales”, se anima el especialista, y continúa: “El grupo que me acompaña está muy entusiasmado con la idea de que los resultados no queden sólo en el laboratorio y puedan ser aprovechados por toda la sociedad”.
| El Grupo de Biofísica y Neuroquímica que coordina el Dr. Falomir Lockharten el INIBIOLP es parte del Laboratorio de Biofísica y Biología Celular de Proteínas que Unen Lípidos dirigido por la Dra. Betina Córsico. El equipo se completa con el Dr. A. Martín Toscani, Lic. Ezequiel Giménez y los estudiantes Antonella León (UNNOBA), Ma. Alejandra Carrero Rivero y Gian Franco Cavazzutti (UNLP). |
Sobre investigación.
– Lisando Falomir Lockhart. Investigador asistente. INIBIOLP.
Por Mercedes Benialgo. CCT La Plata.