IFIBYNE
Los secretos del código celular
El splicing alternativo es el proceso que le permite a la célula obtener diferentes proteínas a partir de un único gen. Su rol en temas tan diferentes como evolución de especies y cáncer.
Algunos lo comparan con la confección de prendas a medida, donde a partir de un mismo corte de tela se pueden obtener distintos trajes. Y es que a través del proceso de splicing alternativo (SA), uno de los más complejos de la naturaleza, es posible obtener diferentes proteínas a partir de un único gen.
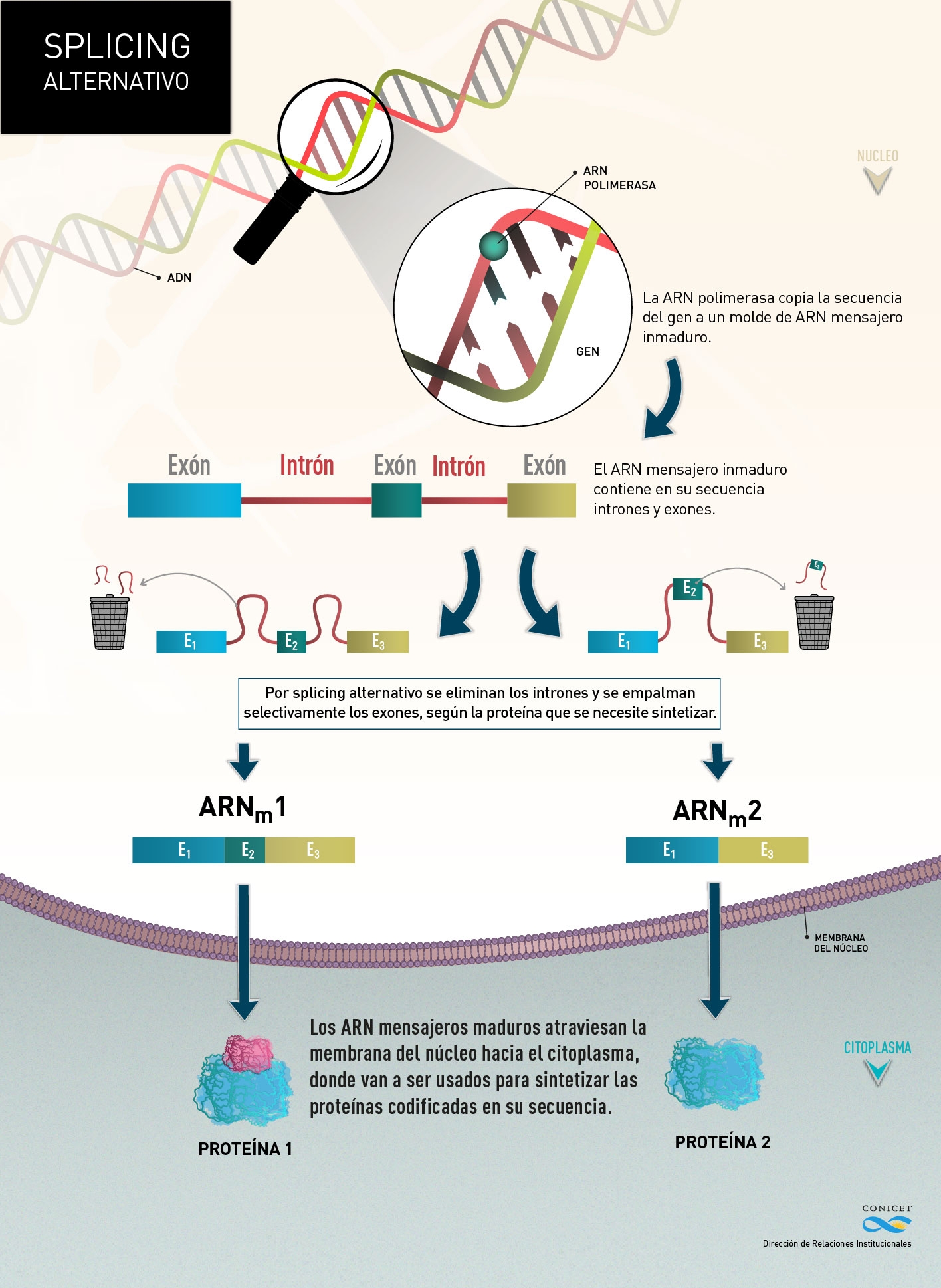
Pero, ¿cómo ocurre? En la célula el material genético, ADN – ácido desoxiribonucleico – está contenido dentro del núcleo, que está a su vez rodeado por una membrana. Cuando la célula necesita producir una proteína, selecciona el gen que contiene en su estructura la secuencia necesaria y lo copia a un molde de ARN – ácido ribonucleico – llamado mensajero inmaduro.
Ese ARN mensajero (ARNm) inmaduro incluye grandes regiones, llamadas intrones, y áreas más pequeñas, exones, que contienen la información necesaria para la síntesis de la proteína en cuestión. El proceso de maduración del ARN – splicing – elimina los intrones y une a los exones para producir una molécula de ARN mensajero maduro capaz de salir del núcleo hacia el citoplasma, donde ocurre la síntesis de proteínas.
Cuando ese proceso de corte y pegado de exones es selectivo, es decir que no todos los exones quedan incluidos en el mensajero maduro, estamos en presencia de splicing (“empalme”) alternativo. Según las señales que reciban, las proteínas que lo regulan dejan dentro de la estructura del ARNm maduro la secuencia de exones que codifica para la molécula necesaria.
(click aquí para agrandar)
Un splicing para cada necesidad
Un caso descripto recientemente por investigadores de la Universidad de California en San Francisco, Estados Unidos, es el de los murciélagos vampiros (Desmodus rotundus), que se alimentan de sangre. Estos animales desarrollaron un sensor en un órgano especial de la cara que detecta la radiación infrarroja y les sirve para ubicar a sus presas de sangre caliente.
Alberto Kornblihtt, investigador superior del CONICET en el Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE) y profesor en la Facultad de Ciencias Exactas y Naturales (FCEyN) de la UBA, explica que el gen que codifica para este sensor está presente en todos los mamíferos pero sólo se activa frente a temperaturas superiores a los 60 ºC para alejarlos del calor excesivo y evitar quemaduras.
“Sin embargo en ciertos tejidos de estos vampiros, a través de mecanismos de SA, el umbral de detección baja a 30 ºC, y eso les permite ubicar a sus presas que son también mamíferos y mantienen su cuerpo a 36-37 ºC”, asegura.
De acuerdo con el investigador, uno de los puntos más interesantes es que este proceso está presente selectivamente sólo en determinadas áreas del rostro de los vampiros – que usan para sensar a sus presas – y no en el resto del cuerpo. “Es entonces un splicing específico de la especie y del tejido”, asegura.
El SA es un proceso sumamente flexible. Un ejemplo es el gen Dscam de la Drosophila melanogaster o mosca de la fruta, que por splicing alternativo puede dar origen a más de 38 mil diferentes proteínas. Esta enorme plasticidad es utilizada por las células del cerebro, que expresan las diferentes proteínas codificadas en la secuencia del gen para reconocerse entre ellas.
“Cada célula expresa combinaciones diferentes (de proteínas) en grupos diferentes y así saben cuando se contacta a ella misma. Esta gran complejidad es usada para identificar a las neuronas propias de las ajenas y eso es simplemente asombroso”, comenta Philip Sharp, uno de los ganadores del Premio Nobel de Fisiología o Medicina en 1993 por el descubrimiento del splicing.
Cuestión de piel
En 2009 investigadores del IFIBYNE y la FCEyN describieron por primera vez un mecanismo particular que se desencadena en respuesta a la irradiación de células con luz ultravioleta. Este tipo de luz, emitida por el Sol, es capaz de dañar el ADN y causa mutaciones que podrían derivar en el desarrollo de células cancerosas.
“Encontramos que al irradiar células con luz UV se iniciaba una cascada de eventos que modulaban el SA y afectan a su vez la vida y muerte de la célula. Esto resulta interesante ya que es indeseable que una célula con su material genético dañado deje descendencia”, detalla Manuel Muñoz, investigador asistente del CONICET en el IFIBYNE y primer autor del estudio.
Durante la investigación observaron que en las células expuestas a luz UV los patrones de SA se afectaban en gran medida, pero en forma indirecta: la radiación no actuaba directamente sobre el splicing sino sobre la transcripción, que es la etapa donde el gen es copiado desde el ADN al molde de ARN inmaduro.
Muñoz cuenta que los resultados mostraron que la luz UV afectaba a la enzima encargada de este proceso, llamada ARN polimerasa. “Es el primer caso descripto donde un factor externo – en este caso la luz UV – afecta la velocidad a la que actúa la ARN polimerasa y termina favoreciendo la producción de determinadas proteínas frente a otras”, explica el investigador quien remarca que, “interesantemente, muchas proteínas involucradas en decisiones de vida o muerte celular están afectadas por el SA”.
Frente al daño al ADN, la célula puede tomar dos caminos: o programar su muerte, también llamado suicidio celular, o detener su ciclo de vida hasta reparar los errores en el ADN.
“Hay proteínas que reconocen el daño en el material genético y ayudan a su reparación. En la actualidad estamos investigando si esas mismas proteínas son las que gatillan cambios en la señalización interna de la célula que afectan el splicing alternativo y producen estos cambios”, resume Kornblihtt, director de la investigación.
Para Sharp, el estudio de los mecanismos que regulan y afectan el splicing alternativo reviste un potencial para el desarrollo de futuros tratamientos. “Hay algunos trabajos que se están haciendo y muestran signos de éxito para diferentes patologías donde está afectado el splicing alternativo, como en la atrofia muscular espinal”, señala.
- Por Ana Belluscio.
- Sobre investigación
- Alberto R. Kornblihtt. Investigador superior. IFIBYNE.
- Manuel Muñoz. Investigador asistente. IFIBYNE.
- Philip Sharp. Instituto Tecnológico de Massachusetts (MIT). Estados Unidos.